 Kimya dersinde atomlar, moleküller, moleküllerin oluşumu gibi çok çeşitli konular işlenmektedir. Moleküllerde atomları bir arada tutan kuvvet kimyasal bağdır.
Kimya dersinde atomlar, moleküller, moleküllerin oluşumu gibi çok çeşitli konular işlenmektedir. Moleküllerde atomları bir arada tutan kuvvet kimyasal bağdır.
Moleküllerdeki bağlar oluşurken dışarıya enerji verirler. Atomlar bağ yaparken, elektron dizilişlerini soygazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eşittir.
Kimyasal bağ, çekirdekteki atomları bir arada tutan kuvvettir. İki ya da daha fazla atom arasında elektron alışverişi veya ortak kullanımı ile kimyasal bağlar oluşmaktadır. Atomlar tek başına bulundukları zamankinden daha düşük enerjili duruma erişmek için bir arada olur. Kimyasal bağlar sayesinde birarada, belli bir geometri oluştururlar. Bu geometriyi oluştururken amaç elektron dizilişlerini soygazlara benzetmeye çalışmaktır. Birçok fiziksel özellik elektriksel bağların cinsine bağlıdır ve bu kimyasal bağlar ile farklı maddeler meydana gelmektedir. Kimyasal bağın kuvvetli olması sertliğini ve erime noktasını yükseltir.
+ ve – yüklü farklı yüklü iyonların elektriksel çekim kuvvetlerinden ortaya çıkan bağ türüdür. Metaller ile ametaller arasında gerçekleşir ve metallerin elektron vermesi, ametallerin ise elektron almasıyla oluşur.
İyonik bağı yapan atomlardan elektron veren (+) yüklü, elektron alan (–) yüklü iyon olur ve zıt çekim kuvveti iyonları bir kristal içinde tutar. Bu kuvvetli çekim iyonik bağlı bileşikleri ayrıştırmayı zorlaştırır. Atomlardan biri, elektron kaybedip pozitif yüklü iyona dönüşürken, diğer atom elektron kazanıp negatif yüklü iyonu oluşturur.
Atomlardan elektron kaybı sonucu oluşan pozitif (+) iyonlara katyon; elektron kazanarak oluşan negatif (-) iyonlara ise anyon denilmektedir.
İyonik Bağlı Bileşiklerin Özellikleri Nelerdir?
İyonik bileşikler kristal yapıdadırlar ve oda sıcaklığında katı halde bulunurlar. Katı halleri elektriği iletmezken, sulu çözeltileri ve sıvı halleri elektrik akımını iletir. İyonlaşma enerjisi düşük elementler ile elektron ilgisi yüksek elementler arasında en kararlı bileşikler oluşur.
İyonik bağlı bileşiklere örnekler;
NaCl, MgS, BaCl2 NaOH, NH4NO2, FeO,
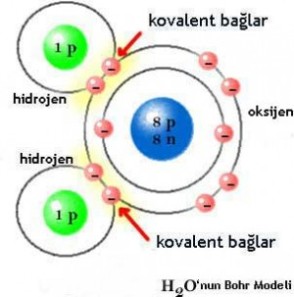
Bazı ametal atomlarının atomları kendi aralarında kararlı yapıya ulaşmak için son yörüngedeki bazı elektronlarını ortak kullanırlar. Ortaklaşa kullanılarak oluşturulan bağa kovalent bağ ve oluşan bileşiklere kovalent bağlı bileşikler denir. Kovalent bağların oluşması sırasında herhangi bir elektron aktarımı gerçekleşmez.
Örneğin, C, N, S, F,Cl, Br, I, O ve H elementlerinin kendi aralarında oluşturdukları bileşikler kovalent bağlı bileşiklerdir.
Kovalent bağlı bileşikleri apolar kovalent ve polar kovalent bağ olarak ikiye ayrılır.
Apolar Kovalent Bağ Aynı cins ametal atomları arasında kovalent bağlı bileşikler oluşur. Örneğin; Cl2, H2, O2 gibi moleküller apolar kovalent bağlıdır.
Ortaklaşa kullanılan elektronlar eşit paylaşıldığından molekülün pozitif veya negatif kutbu yoktur; yani kutupsuz bir bağdır.
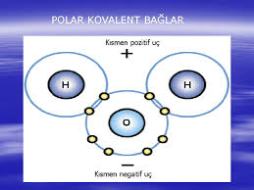
Farklı cins ametal atomların yapmış oldukları kutuplu bağlardır. Elektronlar iki atom arasında eşit olarak paylaşılmadığından kutuplaşma oluşur . Aametallerden biri ortaklaşa kullanıldığından dolayı molekülün bir ucu pozitif (+), diğer ucu negatif (-) yüklenir.
HCl, HF, CO2, NO, CO, OF2, CO2, H2O gibi moleküller polar kovalent bağa örnek verilebilir.
İki atomun elektron çekme yetenekleri arasındaki farkın büyüklüğü arttıkça kimyasal bağ daha polar hale gelmektedir.
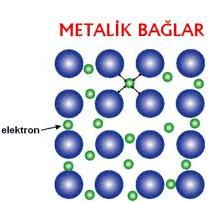
Metal atomlarını katı ve sıvı halde bir arada tutan kuvvetlerdir ve metal atomları arasında metal bağı etkişimini oluştururlar. Metallerde değerlik(valens) elektronlar, atom çekirdekleri tarafından kuvvetli tutulmazlar. Bunun sebebi metallerin iyonlaşma enerjilerinin ve elektronegatifliklerinin oldukça düşük olmasıdır. Böylece metal atomlarının en dış elektronları nispeten gevşek tutulmaktadır. Bu bağ metal atomlarının değerlik elektronlarını bir elektron bulutuna vermesi ile oluşan bağdır ve bu şekilde elektronlar serbestçe hareket edebilmektedirler. Bu da metallerde yüksek ısı ve elektrik iletkenliğine sebep olur.
İyonlaşma enerjisi azaldıkça metalik bağlar zayıflamakta ve değerlik elektronları sayısı artıkça metalik bağ kuvveti artmaktadır.
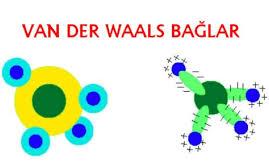
Pozitif olarak yüklenmiş molekülün bir kısmı ve negatif olarak yüklenmiş ikinci molekülün bir kısmı arasındaki kısa süreli zayıf çekim kuvvetidir. Molekülde elektronların yoğun olduğu taraf kısmen negatif, diğer taraf da kısmen pozitif yükle yüklenir. Pozitif ve negatif yüklü kısımları arasındaki kuvvetlerin etkisi ile moleküller arasında oluşan bağlara van der waals bağları denilmektedir.
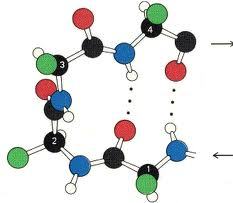
Hidrojen Bağı
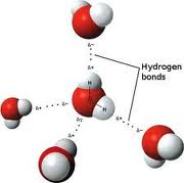 Hidrojenin elektron ilgisi büyük atomlarla oluşturduğu bileşiklerde, molekülleri bir arada tutan kuvvete hidrojen bağı denir. H atomunun kovalent olarak bağlandığı yüksek elektronegatiflikteki atom, bağ elektronlarını kendine doğru çeker ve bir hidrojen bağı oluşturur.
Hidrojenin elektron ilgisi büyük atomlarla oluşturduğu bileşiklerde, molekülleri bir arada tutan kuvvete hidrojen bağı denir. H atomunun kovalent olarak bağlandığı yüksek elektronegatiflikteki atom, bağ elektronlarını kendine doğru çeker ve bir hidrojen bağı oluşturur.
Biokimyasal sistemlerin yapıları kısmen hidrojen bağı etkileşmelerinin sonucu olarak belirlenir.









Warning: A non-numeric value encountered in /var/www/vhosts/acilservis.pro/httpdocs/wp-content/themes/acilservis/inc/function-opt.php on line 949
Fiziksel bağ soruoz nerde bu ?